Domingo
18 de Enero de 2026
16 de febrero de 2021
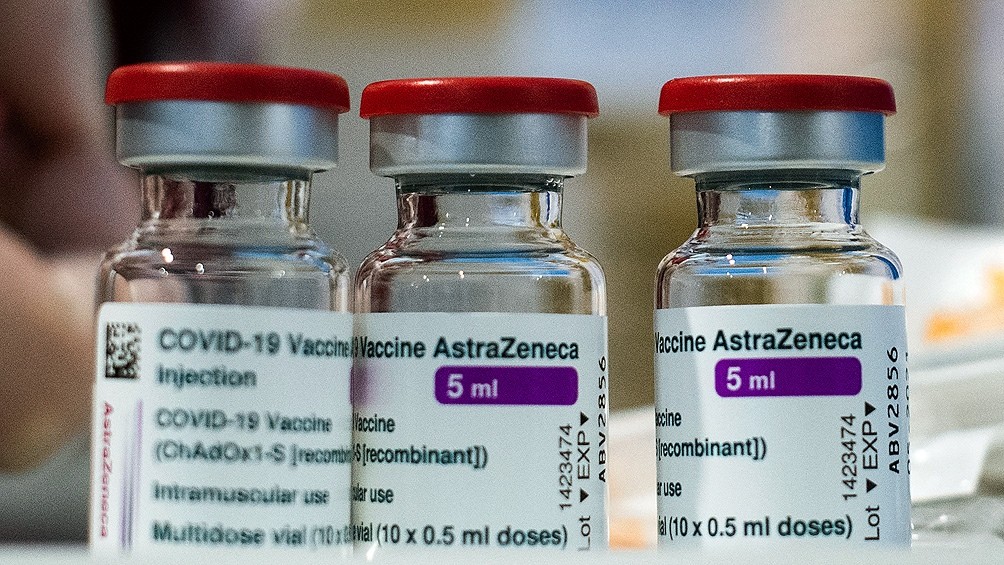
🗣(Compartí con nosotros tus comentarios, denuncias, fotos y videos al WhatsApp 3624100411)
La decisión allana el camino para la distribución de cientos de millones de dosis a países desfavorecidos, privados hasta ahora de inmunización.
El antígeno de Oxford-AstraZeneca es el segundo que autoriza la OMS, luego de que el 31 de diciembre pasado aprobara el de Pfizer-BioNTech y diera luz verde para ser parte de la iniciativa Covax.
"Países sin acceso a las vacunas hasta hoy podrán finalmente ser capaces de empezar la inmunización de su personal sanitario y de las poblaciones más vulnerables", declaró la doctora Mariangela Simao, subdirectora general de la OMS responsable del acceso a los medicamentos
Este procedimiento, al que puede recurrir el organismo de Salud de la Organización Naciones Unidas (ONU) en caso de emergencia sanitaria, ayuda a los países que no tienen los medios para determinar por sí mismos la eficacia y la seguridad de un medicamento, a fin de tener un acceso más rápido.
En este sentido, también permitirá comenzar su distribución a la iniciativa Covax, codirigido por la OMS, la alianza de vacunas Gavi y la Coalición para las Innovaciones en Preparación para Epidemias para garantizar un acceso equitativo a las vacunas.
Las dos versiones aprobadas de la vacuna de AstraZeneca, que se fabricarán en Corea del Sur y en India, representan una inmensa mayoría de los 337,2 millones de dosis de vacunas para Covax, dirigido por la OMS, la Alianza para la Vacunación (Gavi) y la Coalición para las Innovaciones en Preparación para Epidemia (Cepi), quiere distribuir en el primer semestre de este año.
La semana pasada, el comité de expertos de la OMS ya recomendó este fármaco para cualquier persona mayor de 18 años, incluyendo en los países donde circulan las variantes del virus más contagiosas.
Y eso pese a que el producto de AstraZeneca suscitó dudas sobre su eficacia en los mayores de 65 años o ante la mutación detectada en Sudáfrica.
Para la OMS y sus expertos, sin embargo, esta vacuna cumple perfectamente con las prioridades del momento: limitar la gravedad y la mortalidad de una epidemia que ya se ha cobrado más de 2,4 millones de vidas en un año.
Las dos versiones aprobadas de la vacuna de AstraZeneca, que se fabricarán en Corea del Sur y en India, representan una inmensa mayoría de los 337,2 millones de dosis de vacunas para Covax